Die Parkinson-Forschung entwickelt sich rasant. Während krankheitsmodifizierende Therapien noch in der Entwicklung sind, bleibt eine verbesserte tägliche Symptomkontrolle für Menschen, die heute mit Parkinson leben, von zentraler Bedeutung.
In diesem zweiten Beitrag unserer dreiteiligen Serie über neue Parkinson-Therapien richten wir den Blick auf Dopaminbehandlungen der nächsten Generation. Im Fokus steht Tavapadon – eine intelligentere, selektivere Dopamintherapie, die motorische Symptome lindern soll, dabei jedoch viele der Nebenwirkungen heutiger Medikamente vermeidet. Diese orale Therapie befindet sich derzeit in späten klinischen Entwicklungsphasen für sowohl frühe als auch fortgeschrittene Parkinson-Stadien und stellt einen wichtigen Fortschritt in der symptomatischen Behandlung dar.
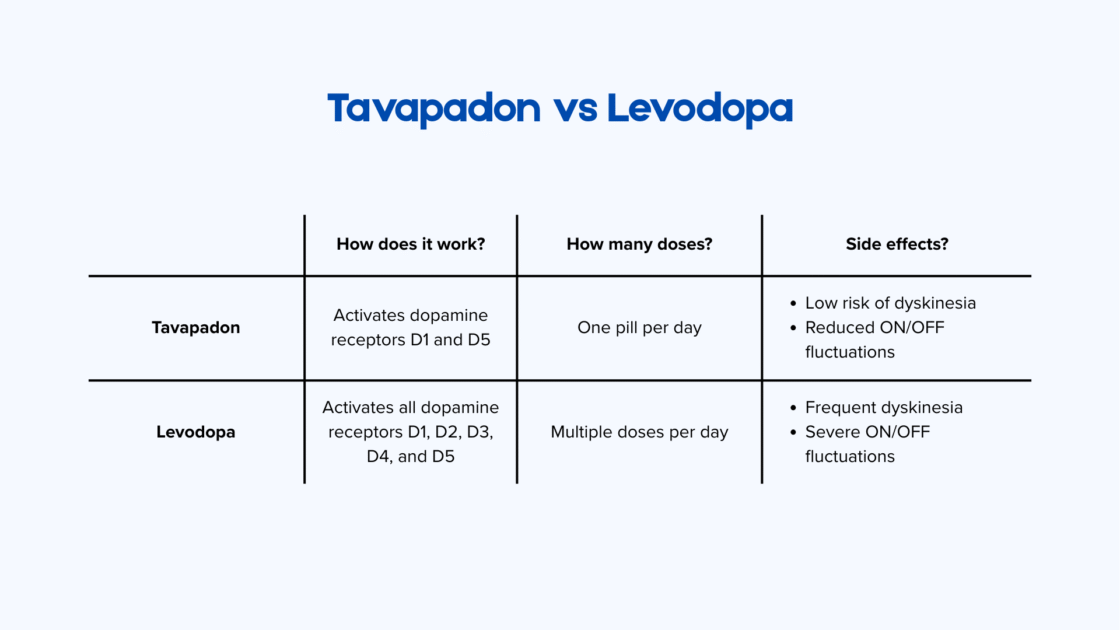
Wie unterscheidet sich Tavapadon von Levodopa bei der Parkinson-Krankheit?
Im Gehirn gibt es fünf Dopaminrezeptoren: D1, D2, D3, D4 und D5. Die Rezeptoren D1 und D5 spielen eine zentrale Rolle bei der motorischen Kontrolle, während D2, D3 und D4 stärker an der Neuronenentwicklung beteiligt sind. Wenn der Körper Levodopa in Dopamin umwandelt, aktiviert Dopamin alle fünf Rezeptoren gleichzeitig, um die Bewegungsfähigkeit wiederherzustellen. Diese Überstimulation trägt zur Entstehung von Dyskinesien bei.
Tavapadon ist eine Dopamintherapie, die vom Pharmaunternehmen AbbVie (USA) entwickelt wurde. Sie ist hochselektiv und aktiviert ausschließlich die D1- und D5-Rezeptoren. Dieser gezielte Ansatz kann dazu beitragen, Nebenwirkungen zu vermeiden, die mit einer breiteren Aktivierung von Dopaminrezeptoren verbunden sind. Zudem bleibt Tavapadon 24 Stunden im Körper aktiv und ermöglicht dadurch eine einmal tägliche Einnahme1.
Phase-3-TEMPO-Studien: Klinische Evidenz für Tavapadon bei Parkinson
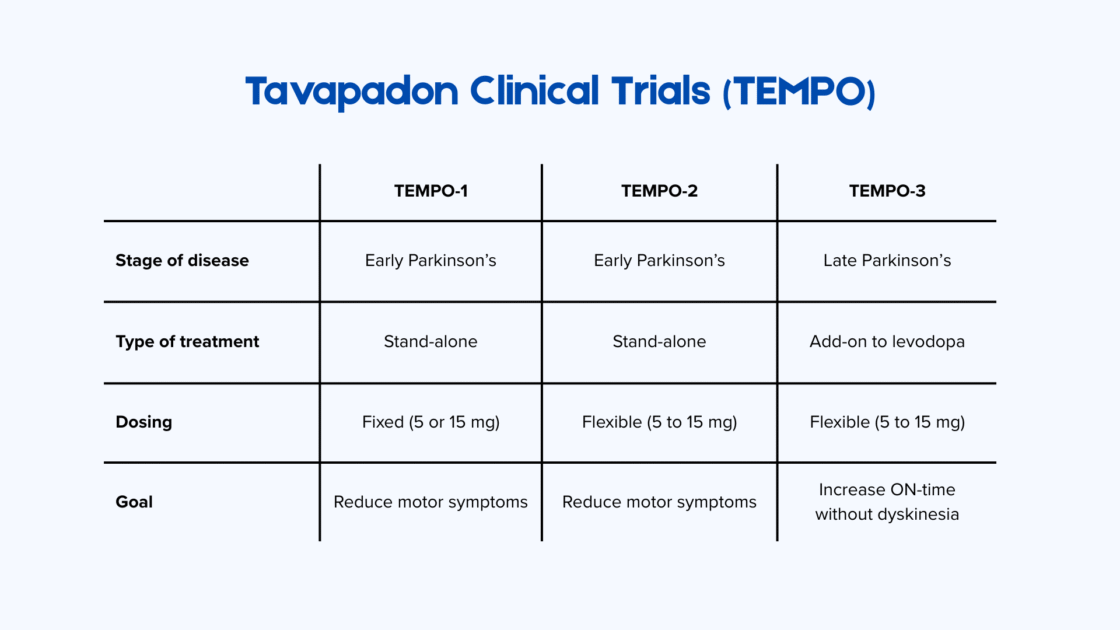
Der therapeutische Nutzen von Tavapadon wurde im vergangenen Jahr in einer Reihe von Phase-3-Studien bestätigt – TEMPO-1, TEMPO-2 und TEMPO-32.
In TEMPO-1 und TEMPO-2 wurde Tavapadon als Monotherapie bei Menschen mit frühem Parkinson-Stadium (Diagnose seit weniger als drei Jahren) untersucht. Beide Studien dauerten 27 Wochen und nutzten die kombinierten MDS-UPDRS-Teil-II- und -Teil-III-Scores zur Messung von Verbesserungen der motorischen Symptome und der Alltagsaktivitäten. In TEMPO-1 erhielten 529 Patientinnen und Patienten eine feste tägliche Dosis Tavapadon (5 mg oder 15 mg). In TEMPO-2 erhielten 304 Teilnehmende eine flexible, bis auf 15 mg pro Tag angepasste Dosierung. In beiden Studien führte Tavapadon im Vergleich zu Placebo zu signifikanten motorischen Verbesserungen.
TEMPO-3 untersuchte Tavapadon als Zusatztherapie zu Levodopa bei Menschen mit fortgeschrittenem Parkinson, die unter motorischen Fluktuationen litten. In diese Studie wurden 507 Patientinnen und Patienten aufgenommen, die eine stabile Levodopa-Dosis einnahmen, aber dennoch täglich mindestens 2,5 Stunden „OFF“-Zeit hatten. Wie in TEMPO-2 setzten die Forschenden ein flexibles Dosierungsschema von 5–15 mg einmal täglich ein. Teilnehmende, die Tavapadon zusätzlich einnahmen, verzeichneten etwa eine zusätzliche Stunde guter ON-Zeit ohne Dyskinesien sowie eine Reduktion der OFF-Zeit um rund eine Stunde, ohne eine Zunahme von Dyskinesien.
Weitere aktuelle Studien und Einordnungen finden Sie im Parkinson-Blog.
Langzeitsicherheit und regulatorischer Ausblick für Tavapadon
Bei einigen Teilnehmenden traten leichte bis moderate Nebenwirkungen wie Übelkeit, Kopfschmerzen und Mundtrockenheit auf. Wichtig ist, dass in der TEMPO-3-Studie die Häufigkeit von Halluzinationen und Impulskontrollstörungen mit Placebo vergleichbar war. Dies deutet darauf hin, dass Tavapadon viele der Nebenwirkungen vermeidet, die mit der Stimulation von D2/D3-Rezeptoren verbunden sind.
Eine vierte Studie, TEMPO-4, schloss 992 Teilnehmende ein, um die Langzeitsicherheit und Dauerhaftigkeit der Wirkung von Tavapadon über 58 Wochen zu untersuchen. Die Studie wurde im Dezember 2025 abgeschlossen. Obwohl die Ergebnisse in Kürze erwartet werden, hat AbbVie bereits bei der FDA die Zulassung zur Vermarktung von Tavapadon beantragt3. Die behördliche Prüfung kann bis zu einem Jahr dauern, was bedeutet, dass Tavapadon – sofern die Daten positiv ausfallen – möglicherweise innerhalb dieses Jahres zugelassen wird und auf den Markt kommen könnte.
Auch wenn Tavapadon das Fortschreiten der Erkrankung nicht verlangsamt, hat es das Potenzial, den Alltag von Betroffenen spürbar zu verbessern, indem es motorische Fluktuationen reduziert und viele Nebenwirkungen bestehender Dopamintherapien vermeidet. Bei einer Zulassung könnte es relativ bald für Patientinnen und Patienten verfügbar sein und eine bessere Symptomkontrolle ermöglichen, während krankheitsmodifizierende Therapien weiter voranschreiten.
Bleiben Sie dran für Teil 3, in dem wir uns auf zellbasierte Therapien konzentrieren, die darauf abzielen, verlorene dopaminerge Neuronen zu ersetzen und die Gehirnfunktion wiederherzustellen. Melde Dich jetzt zu unserem Parkinson-Newsletter an.
Mehr über uns
–> Lerne unsere Autorin Susy kennen
Referenzen
- Kaye AD, Ford BM, Abbott BM, Broocks KM, Novacic S, Shekoohi S. Emerging Clinical Role of Tavapadon, a Novel Dopamine Partial Agonist, in the Treatment of Parkinson’s Disease. Diseases. 2025;13(9):290. Published 2025 Sep 2. doi:10.3390/diseases13090290 ↩︎
- Bezard E, Gray D, Kozak R, Leoni M, Combs C, Duvvuri S. Rationale and Development of Tavapadon, a D1/D5-Selective Partial Dopamine Agonist for the Treatment of Parkinson’s Disease. CNS Neurol Disord Drug Targets. 2024;23(4):476-487. doi:10.2174/1871527322666230331121028 ↩︎
- https://news.abbvie.com/2025-09-26-AbbVie-Submits-New-Drug-Application-to-U-S-FDA-for-Tavapadon-for-the-Treatment-of-Parkinsons-Disease ↩︎






Schreibe einen Kommentar